Сабақ жоспары (ұмж): Қышқылдардың, негіздердің, тұздардың электролиттік диссоциациясы. «Қышқылдық және сілтілік ерітінділердің рН анықтау» (Химия, 9 сынып, I тоқсан)
Пән: Химия
Ұзақ мерзімді жоспар бөлімі: Электролиттік диссоциация
Сабақтың тақырыбы: Қышқылдардың, негіздердің, тұздардың электролиттік диссоциациясы. «Қышқылдық және сілтілік ерітінділердің рН анықтау»
Осы сабақта қол жеткізілетін оқу мақсаттары (оқу бағдарламасына сілтеме): - заттарды электролиттерге және бейэлектролиттерге, күшті және әлсіз электролиттерге жіктеу;
- диссоциация үдерісіндегі судың маңызын түсіну.
Сабақ мақсаттары: Электролиттер мен электролиттер емес туралы оқушылардың білімін қалыптастыру, электролиттік диссоциация теориясы негізгі принциптерін талдау.
Ұйымдастыру кезі.
Сынақ сұрақтары
Ерітіну дегеніміз не?
• Қандай шешімдер бар?
• Физика-химиялық процесс
• Ерітінді, еріткіш және олардың өзара әрекеттесу өнімдері-гидраттардан тұратын біртекті біртекті жүйе
Сабақтың тақырыбын және сабақтың мақсаттарын
Есте сақтау маңызды
Шешімдер теориясы даму тарихы
Физикалық теория
Еріту - диффузияның нәтижесі.
Ерітінді – бұл біртекті қоспалар.
Вант- Гофф, Аррениус, Оствальд
2. Химиялық теория
Еріту - бұл судың ерітіндісінің химиялық өзара әрекеттесуі, ол гидратация деп аталады.
Ерітінді - бұл химиялық қосылыстар, гидраттар.
Менделеев, Каблуков, Кистяковский.
3. Қазіргі шешімдер теориясы?
• Электролиттер мен электролит емес түсініктер.
• Ионды және коваленттік байланыстары бар заттардың диссоциациялану механизмін қарастырыңыз.
• Тұжырымдаманы, электролиттік диссоциация дәрежесін енгізіңіз және электролиттердің жіктелуін қарастырыңыз.
• Затты электрөткізгіштігі аспаппен тексерілуі мүмкін. Құрылғының электродтары арасында кернеу - 36 вольт. Электродтар затқа орналастырылған кезде, бұл зат ток өткізетіні анық болады. Егер зат электр тогын өткізсе, тізбек жабылады да, жарық қосылады. Егер зат өткізбейтін болса, тізбек ашық қалады және жарық өшіріледі.
• Қатты денелерді сынау. Петри ыдысында қантты құйып, оны электродтарға әкеліңіз. Жарық жанып кетпейді, сондықтан қант (органикалық заттар) электр тоғын өткізбейді. Қатты натрий гидроксидінің (NaOH) алкалиі ақ ток өткізбейді. Ас тұзын алыңыз - кристалды натрий хлориді (NaCl). Жарық өшірулі. Барлық сыналған қатты бөлшектер электр тоғын өткізбейді.
• Электропроводны ли растворы этих веществ?
• Сұйықтықтарды тексеру. Натрий гидроксиді ерітіндісі электр өткізгіштігі бар: жарық жанып тұрады. Тұз ерітіндісін сынағанда жарық қосылады. Тұз қышқылының (HCl) ерітіндісі электр өткізгіш болып табылады. Барлық сыналған шешімдер электролит болды. (Электрлік өткізгіш сұйықтықтар электролит деп аталады, электролиттердің электр өткізгіштігі иондармен қамтамасыз етіледі.) Дистильденген судың электролит екенін тексеріңіз. Жарық өшірулі. Дистилденген суда өте аз ион бар, сондықтан су өткізгіштігі аз. Дистилденген су өте әлсіз электролит. Қант ерітіндісінде мобильді зарядталған бөлшектер жоқ. Электр тізбегіндегі ток жүрмейді. Қант ерітіндісі электролит емес. Алкоголь, қант ерітіндісі сияқты, электролит емес.
• Жабдықтар: заттардың өткізгіштігін сынау үшін орнату (түзеткіш, электродтар, қыздыру шамдары), Петри ыдыс-аяғы, стақандар.
• Қауіпсіздік ережесі
• Қышқылдар мен сілтілермен жұмыс істеу ережелеріне, электр құрылғыларымен жұмыс істеу ережелеріне бағынады.
Жұпта жұмыс істеу
Тәжірибе.. Тұз ерітіндісінің электр өткізгіштігі сынағы
Критерий бойынша жұптық өзара бағалау (тарату)
Ионды химиялық байланыспен заттардың диссоциациялану механизмі (презентацияны қараңыз).
Ковалентті химиялық байланыспен заттардың диссоциациялану механизмі (презентацияны қараңыз)
Электролиттер
Суда ериді немесе еріген кезде олар иондарға (диссоциациялауға) оң (катиондар) және зарядталған бөлшектердің терісіне (разрядты) бөлінеді.
Ерітінділер мен балқымалардың электролиттерінде электр тоғын өткізеді.
Электролит емес – бұл су ерітінділері немесе балқымалары электр тогын өткізбейтін заттар болып табылады
Қышқыл диссоциация
Электролит қышқылдар деп аталады, диссоциация кезінде катиондар катиондары ретінде ғана пайда болады.сутегі (H +).
Мысалы
HCl > H+ + Cl -
HNO3- > H + + NO3 -
Көпнегізгі қышқылдары қадамдармен бөлінеді:
Н3РО4 ↔ Н+ + Н2РО₄- (первая ступень) – дигидрофосфат- ион
Н2РО4- ↔ Н+ + НРO₄2- (екінші кезең) – гидрофосфат- ион
НРО42- ↔ Н+ + PО4З - (үшінші кезең) – ортофосфат-ион
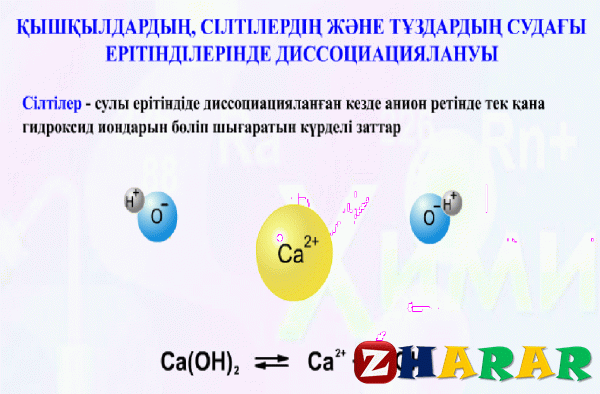
Негіздердің разряды (сілтілер)
Негіздері электролит деп аталады, диссоциация кезінде аниондар ретінде тек гидроксид иондары (OH -) пайда болады.
KOH -> K + + OH -;
NH4OH ↔ NH4+ + OH -
Көп қышқылдық негіздер қадамдарға бөлінеді:
Ba(ОН)2 -> Bа(ОН)+ + OH-(бірінші кезең)
Ba(OH)+ ↔ Ba2++ OH- (екінші кезең)
Диссоциация солей.....
Ұзақ мерзімді жоспар бөлімі: Электролиттік диссоциация
Сабақтың тақырыбы: Қышқылдардың, негіздердің, тұздардың электролиттік диссоциациясы. «Қышқылдық және сілтілік ерітінділердің рН анықтау»
Осы сабақта қол жеткізілетін оқу мақсаттары (оқу бағдарламасына сілтеме): - заттарды электролиттерге және бейэлектролиттерге, күшті және әлсіз электролиттерге жіктеу;
- диссоциация үдерісіндегі судың маңызын түсіну.
Сабақ мақсаттары: Электролиттер мен электролиттер емес туралы оқушылардың білімін қалыптастыру, электролиттік диссоциация теориясы негізгі принциптерін талдау.
Ұйымдастыру кезі.
Сынақ сұрақтары
Ерітіну дегеніміз не?
• Қандай шешімдер бар?
• Физика-химиялық процесс
• Ерітінді, еріткіш және олардың өзара әрекеттесу өнімдері-гидраттардан тұратын біртекті біртекті жүйе
Сабақтың тақырыбын және сабақтың мақсаттарын
Есте сақтау маңызды
Шешімдер теориясы даму тарихы
Физикалық теория
Еріту - диффузияның нәтижесі.
Ерітінді – бұл біртекті қоспалар.
Вант- Гофф, Аррениус, Оствальд
2. Химиялық теория
Еріту - бұл судың ерітіндісінің химиялық өзара әрекеттесуі, ол гидратация деп аталады.
Ерітінді - бұл химиялық қосылыстар, гидраттар.
Менделеев, Каблуков, Кистяковский.
3. Қазіргі шешімдер теориясы?
• Электролиттер мен электролит емес түсініктер.
• Ионды және коваленттік байланыстары бар заттардың диссоциациялану механизмін қарастырыңыз.
• Тұжырымдаманы, электролиттік диссоциация дәрежесін енгізіңіз және электролиттердің жіктелуін қарастырыңыз.
• Затты электрөткізгіштігі аспаппен тексерілуі мүмкін. Құрылғының электродтары арасында кернеу - 36 вольт. Электродтар затқа орналастырылған кезде, бұл зат ток өткізетіні анық болады. Егер зат электр тогын өткізсе, тізбек жабылады да, жарық қосылады. Егер зат өткізбейтін болса, тізбек ашық қалады және жарық өшіріледі.
• Қатты денелерді сынау. Петри ыдысында қантты құйып, оны электродтарға әкеліңіз. Жарық жанып кетпейді, сондықтан қант (органикалық заттар) электр тоғын өткізбейді. Қатты натрий гидроксидінің (NaOH) алкалиі ақ ток өткізбейді. Ас тұзын алыңыз - кристалды натрий хлориді (NaCl). Жарық өшірулі. Барлық сыналған қатты бөлшектер электр тоғын өткізбейді.
• Электропроводны ли растворы этих веществ?
• Сұйықтықтарды тексеру. Натрий гидроксиді ерітіндісі электр өткізгіштігі бар: жарық жанып тұрады. Тұз ерітіндісін сынағанда жарық қосылады. Тұз қышқылының (HCl) ерітіндісі электр өткізгіш болып табылады. Барлық сыналған шешімдер электролит болды. (Электрлік өткізгіш сұйықтықтар электролит деп аталады, электролиттердің электр өткізгіштігі иондармен қамтамасыз етіледі.) Дистильденген судың электролит екенін тексеріңіз. Жарық өшірулі. Дистилденген суда өте аз ион бар, сондықтан су өткізгіштігі аз. Дистилденген су өте әлсіз электролит. Қант ерітіндісінде мобильді зарядталған бөлшектер жоқ. Электр тізбегіндегі ток жүрмейді. Қант ерітіндісі электролит емес. Алкоголь, қант ерітіндісі сияқты, электролит емес.
• Жабдықтар: заттардың өткізгіштігін сынау үшін орнату (түзеткіш, электродтар, қыздыру шамдары), Петри ыдыс-аяғы, стақандар.
• Қауіпсіздік ережесі
• Қышқылдар мен сілтілермен жұмыс істеу ережелеріне, электр құрылғыларымен жұмыс істеу ережелеріне бағынады.
Жұпта жұмыс істеу
Тәжірибе.. Тұз ерітіндісінің электр өткізгіштігі сынағы
Критерий бойынша жұптық өзара бағалау (тарату)
Ионды химиялық байланыспен заттардың диссоциациялану механизмі (презентацияны қараңыз).
Ковалентті химиялық байланыспен заттардың диссоциациялану механизмі (презентацияны қараңыз)
Электролиттер
Суда ериді немесе еріген кезде олар иондарға (диссоциациялауға) оң (катиондар) және зарядталған бөлшектердің терісіне (разрядты) бөлінеді.
Ерітінділер мен балқымалардың электролиттерінде электр тоғын өткізеді.
Электролит емес – бұл су ерітінділері немесе балқымалары электр тогын өткізбейтін заттар болып табылады
Қышқыл диссоциация
Электролит қышқылдар деп аталады, диссоциация кезінде катиондар катиондары ретінде ғана пайда болады.сутегі (H +).
Мысалы
HCl > H+ + Cl -
HNO3- > H + + NO3 -
Көпнегізгі қышқылдары қадамдармен бөлінеді:
Н3РО4 ↔ Н+ + Н2РО₄- (первая ступень) – дигидрофосфат- ион
Н2РО4- ↔ Н+ + НРO₄2- (екінші кезең) – гидрофосфат- ион
НРО42- ↔ Н+ + PО4З - (үшінші кезең) – ортофосфат-ион
Негіздердің разряды (сілтілер)
Негіздері электролит деп аталады, диссоциация кезінде аниондар ретінде тек гидроксид иондары (OH -) пайда болады.
KOH -> K + + OH -;
NH4OH ↔ NH4+ + OH -
Көп қышқылдық негіздер қадамдарға бөлінеді:
Ba(ОН)2 -> Bа(ОН)+ + OH-(бірінші кезең)
Ba(OH)+ ↔ Ba2++ OH- (екінші кезең)
Диссоциация солей.....

Мақала ұнаса, бөлісіңіз:
| |
|
|
|
|
|
|
Ұқсас мақалалар:
» Сабақ жоспары (ұмж): Қышқылдардың, негіздердің, тұздардың электролиттік диссоциациясы. (Химия, 9 сынып, I тоқсан)
» Сабақ жоспары (ұмж): Диссоциациялану дәрежесі. Күшті және әлсіз электролиттер 1-сабақ (Химия, 9 сынып, I тоқсан)
» Сабақ жоспары (ұмж): Диссоциациялану дәрежесі. Күшті және әлсіз электролиттер 2-сабақ (Химия, 9 сынып, I тоқсан)
» Сабақ жоспары (ұмж): Электролиттік диссоциациялану теориясы тұрғысынан қышқыл, негіз, тұздардың химиялық қасиеттері (Химия, 9 сынып, I тоқсан)
» Сабақ жоспары (ұмж): Электролиттік диссоциациялану теориясы (Химия, 9 сынып, I тоқсан)
» Сабақ жоспары (ұмж): Қышқылдардың, негіздердің, тұздардың электролиттік диссоциациясы. (Химия, 9 сынып, I тоқсан)
» Сабақ жоспары (ұмж): Диссоциациялану дәрежесі. Күшті және әлсіз электролиттер 1-сабақ (Химия, 9 сынып, I тоқсан)
» Сабақ жоспары (ұмж): Диссоциациялану дәрежесі. Күшті және әлсіз электролиттер 2-сабақ (Химия, 9 сынып, I тоқсан)
» Сабақ жоспары (ұмж): Электролиттік диссоциациялану теориясы тұрғысынан қышқыл, негіз, тұздардың химиялық қасиеттері (Химия, 9 сынып, I тоқсан)
» Сабақ жоспары (ұмж): Электролиттік диссоциациялану теориясы (Химия, 9 сынып, I тоқсан)
Іздеп көріңіз:



